Bepalingen op het lab
met welk doel?
Gevoeligheidsbepalingen
Bepalingen die de gevoeligheid van een m.o. vaststellen, zodat bekend wordt met welk antibioticum een m.o. te bestijden is en de patiënt dus te genezen is. Deze worden hier besproken in tegenstelling tot de
Aanwezigheidsbepalingen
Bepalingen om vast te stellen of en hoeveel antibioticum ergens in zit , lees hier verder.
De gevoeligheidsbepalingen
Het antibiogram d.m.v. de agardiffusiemethode (Kirby- Bauer)
Inleiding:
Een antibiogram geeft de gevoeligheid weer van een micro-organisme voor een aantal verschillende potentieel antimicrobe stoffen.
Hiervoor gebruikt je agarplaten waarop de te onderzoeken bacterie egaal wordt aangebracht , zodat na incubatie alle kolonies net tegen elkaar zijn gegroeid en er een bacteriedek over de hele plaat is gegroeid.
Voor incubatie brengt je ook de te onderzoeken antibiotica aan. Deze stoffen kunnen in papierschijfjes zijn gedrenkt (waarna de papiertjes gedroogd zijn). Ook kunnen de stoffen in tabletvorm worden opgebracht.
Vervolgens wordt de plaat geïncubeerd.
Voor, maar vooral tijdens de incubatie vinden twee processen plaats:
Groei van de bacterie en Diffusie van de stof.
De stof diffundeert in de agar net zolang totdat de concentratie in de hele plaat hetzelfde is. Voor het zover is zal er een concentratiegradiënt heersen, met een hoge concentratie rondom de opbrengplaats en steeds lagere concentraties naarmate de afstand tot deze plaats groter wordt. Deze concentraties verschillen per tijdstip. Elk antibioticum heeft een eigen diffusiesnelheid.
Na een bepaalde incubatietijd (deze ligt vast) wordt de groei op de plaat beoordeeld en zal er rond een opgebrachte stof al of niet een remzone te zien zijn. Een remzone (hoe klein ook) betekent dat een bacterie gevoelig is voor dat speciale middel. Toch wordt niet elke remzone als gevoelig beoordeeld: de mogelijkheid bestaat dat bij een kleine remzone een heel hoge concentratie antibioticum hoort, zo hoog dat deze concentratie niet bereikt wordt in het bloed van een patiënt of te giftig is in die concentratie. Je mag dus niet zomaar remzones van verschillende antibiotica vergelijken!
Er bestaan tabellen die aangeven hoe groot een remzone rond een schijfje met een bepaald middel minstens moet zijn om de bestudeerde bacterie gevoelig voor dat middel te kunnen noemen. Bij een kleinere remzone wordt de bacterie ongevoelig of resistent genoemd.
UITVOERING.
Bereiding van de voedingsbodem.
Bereid en steriliseer een voor dit doel geschikte vaste voedingsbodem. Giet platen met een dikte van overal 4 mm (waterpas) wat correspondeert met 25 ml medium voor schalen met een binnendiameter van 9 cm. De platen moeten voor het enten gedroogd zijn en op kamertemperatuur.
Het maken van het inoculum
Van elke te onderzoeken stam worden 4 kolonies (die van een plaat gehaald worden die 24 uur van te voren beënt is en die bij 37 C is bebroed geweest) in 4 ml Trypton Soya Bouillon geënt.
De buizen worden 2-5 uur bij 37 C geïncubeerd. Daarna wordt de dichtheid van de cultuur met fysiologisch zout op de juiste waarde gebracht door de troebelheid ervan te vergelijken met een McFarland No. 0,5 standaard (de bacterieverdunning bevat dan ca. 106 kve per ml).
Beënting van de platen
De platen worden met het inoculum door middel van een wattendrager (swab) beënt. Beënt hiertoe met de eenmaal tot verzadiging bevochtigde wattendrager 4 maal één helft van de plaat door egaal over het totale oppervlak uit te strijken: Hierbij overlapt de te beënten helft steeds de vorige helft.
Laat de plaat enkele minuten drogen door het deksel er schuin op te zetten (maximaal 15 minuten)
Het opbrengen van te onderzoeken stoffen Breng de schijfjes waarin zich de te onderzoeken stoffen bevinden op de voedingsbodem met een steriele pincet of dispenser en druk ze tegen de agar aan.
Zet de plaat binnen 15 minuten na opbrengen van de stoffen in de stoof (bodem naar boven). Tenzij anders vermeld bij 37ºC en gedurende 24 uur.
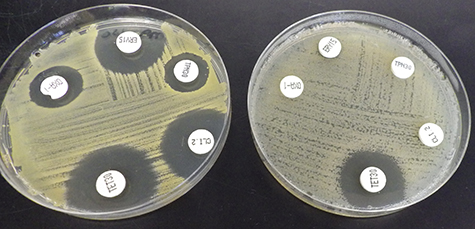
Beoordeling resultaten
Meet nu met een schuifmaat de diameter van de remzone nauwkeurig. De grens is gelegen op de plaats waar met het blote oog geen duidelijke groei meer valt waar te nemen. Geïsoleerde kolonies binnen deze grens worden buiten beschouwing gelaten. Dit geldt eveneens voor latere groei binnen een oorspronkelijke remzone.
Interpretatie
De mate waarin een micro-organisme gevoelig is voor een bepaald middel is met gebruikmaking van een tabel (zie inleiding) na te gaan.Immers de mate van gevoeligheid kan men per antibioticum niet onderling vergelijken, elke stof heeft zijn eigen diffusiesnelheid en dus bij een bepaalde MIC zijn eigen specifieke remzone.Maar dan moeten wel de proefomstandigheden gestandaardiseerd geweest zijn. Omdat er zeer veel factoren van invloed zijn op zowel de diffusie van het antibioticum als de groeisnelheid van het te onderzoeken m.o. is het van groot belang alle omstandigheden en handelingen tijdens de proef zo veel als mogelijk is te standaardiseren:
- De suspensie van het op te brengen micro-organisme dient altijd een concentratie van 106 per ml te hebben.
- De platen moeten een vaste dikte hebben. Incubatietijd en temperatuur dienen altijd hetzelfde te zijn.
- Een schijfje dat eenmaal met de agar in contact geweest is kan men daarna niet meer verplaatsen
- Het medium moet een zodanige samenstelling hebben dat de opgebrachte antibiotica niet in hun diffusie geremd worden, voor deze bepaling zijn dan ook zijn speciale media in de handel.
- Gemeten wordt de zone met de complete remming zoals die met het blote of bebrilde oog zichtbaar is. Zeer kleine nauwelijks zichtbare kolonies worden niet meegerekend. Grote kolonies die midden in de remzone groeien dienen opnieuw getest en geïdentificeerd te worden. Zwermzones binnen de remzones worden niet meegerekend, Lichte groei binnen een zone kan veroorzaakt zijn door mutanten binnen een populatie, of aan de aanwezigheid van een andere soort, men zal dan opnieuw moeten reinkweken , identificeren en gevoeligheid bepalen.
Een tweede methode, meer kwantitatief:
De MIC-bepaling
De te onderzoeken bacterie wordt geënt in een serie buizen met voedingsmedia waarin verschillende concentraties van het te onderzoeken antibioticum.
De laagste concentratie die geen groei te zien geeft is de M.I.C. (Minimal Inhibitory Concentration) of M.R.C.(Minimale Remmende Concentratie) van dit middel voor die bacterie.
De concentraties die ingezet moeten worden dienen (zo dicht mogelijk) rond deze waarde te liggen. Gebeurt dit niet dan is geen M.I.C.(of een te onnauwkeurige M.I.C.) af te lezen.
De juiste in te zetten concentraties zijn niet altijd bekend. Het hieronder gegeven voorbeeld kan in de praktijk dus onjuist zijn en dient dan aangepast te worden aan de situatie (bijv. beschikbare literatuurwaarden voor de M.I.C.).
UITVOERING.
Maak van de te onderzoeken stof een concentratiereeks in duplo. Maak hiertoe een stamoplossing van het antibioticum of andere stof bijv. 32 µg/ml. in steriele bouillon van geschikte samenstelling. Steriliseer zonodig de oplossing door filtratie.
Maak van deze stamoplossing een 1:1 verdunning met het vloeibare medium door 1 deel stamoplossing bij 1 deel medium te pipetteren.
Herhaal dit een aantal malen tot 6 concentraties (in duplo) zijn bereid.
Beent elke buis met een druppel bacteriesuspensie (d.m.v. een Pasteurpipet).De suspensie is bereid uit een overnachtcultuur en bevat ongeveer 106 kve/ml.
Incubeer 24 uur bij geschikte temperatuur.
Beoordeel de concentratiereeks en controle (geen antibioticum) op respectievelijk aan- en afwezigheid van groei (= troebeling) en zoek de M.I.C. waarde op.
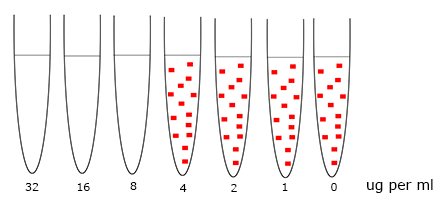
De laagste concentratie die groeiremming te zien geeft is de MIC waarde. In dit voorbeeld 8 ug per ml.
Malditof MS
Eén van de meest voorkomende manieren van resistentie is dat een bacterie enzymen maakt die antibiotica afbreken. Met MALDITOF-MS kunnen de afbraakproducten gedetecteerd worden. Zo kan deze vorm van resistentie heel snel bepaald worden wat voor patient en ziekenhuis erg belangrijk is.
Recent is er een nieuwe methode waarbij heel snel, binnen 1 uur! ,de resistentie bepaald kan worden. is nu in ontwikkeling.
Klik hier voor De bepaling van de (aanwezigheid en de) concentratie van antimicrobe stoffen .