Dissimilatietesten
Dissimilatie van bepaalde koolhydraten
Algemeen
Deze eigenschap wordt zeer veel toegepast bij de identificatie van micro-organismen.
Hierbij wordt gekeken of een micro-organisme een bepaalde stof als energiebron kan gebruiken, dus omzet voor de vorming van energie (ATP). Hierbij wordt de bewuste stof als enig koolhydraat in het medium gestopt, wel is er meestal pepton (bevat ook koolstof)aanwezig als N-bron.
Bij de dissimilatie worden behalve ATP ook zuren en gassen gevormd uit de verbinding gevormd. Zie ook ademhaling en gisting. Hoe minder zuurstof hoe meer gisting en hoe meer zuren.
Deze zuren kan men waarnemen door aan het medium een pH-indicator toe te voegen, daalt de pH dan is dat aan de kleuromslag van de pH-indicator te zien: positieve beoordeling.
Belangrijk bij de beoordeling is de incubatietijd, is het koolhydraat volledig omgezet en het micro-organisme nog in leven, dan zal het de aminozuren uit het pepton gaan gebruiken voor zijn energiewinning, ,dus niet meer uitsluitend als N-bron(assimilatie) , het aminodeel eraf halen waarbij ammoniak ontstaat en de pH stijgt en de pH-indicator weer terug kan omslaan naar zijn oorspronkelijke kleur.
Dit levert dan ogenschijnlijk bij te laat aflezen een negatieve reactie op: vals negatief. Het resterende deel van het aminozuur wordt gedissimileerd.
Het gevormde gas kan worden opgevangen in een klein omgekeerd buisje die men in het medium stopt, een zogenaamd durhambuisje. Ook zonder buisje is de gasvorming wel te zien aan de opstijgende bubbeltjes.

foto Roelof de Schiffart
Omzetting van koolhydraten onder aerobe / anaerobe omstandigheden
Hugh-Leifsontest of OF-test
Of en hoe een koolhydraat door een micro-organisme wordt omgezet in de aanwezigheid of juist afwezigheid van zuurstof wordt bepaald met de zogenaamde Hugh-Leifsontest of OF-test
Hierbij wordt gebruik gemaakt van een agarhoudend medium met de betreffende koolhydraat en een pH-indicator.dit medium wordt in een buis gegoten , bovenin heerst een aeroob milieu, onderin is het anaeroob. In deze buis wordt met een rechte entnaald het te onderzoeken micro-organisme gestoken. Op deze manier kunnen fermentors zoals de enterobacterien onderscheiden worden van zogenaamde non-fermentors als Pseudomonas.
( De test wordt ook wel uitgevoerd met twee buizen, de ene (aerobe) buis wordt gewoon aan de lucht geïncubeerd, de tweede (anaerobe buis) wordt na het enten en voor de incubatie met een laagje olie bedekt.
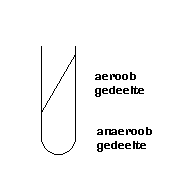 Ook deze media worden in buizen gegoten, maar daana laat men ze schuin stollen waarbij er een grote voet aanwezig moet zijn.
Ook deze media worden in buizen gegoten, maar daana laat men ze schuin stollen waarbij er een grote voet aanwezig moet zijn.
De helling is het aerobe gedeelte.
De voet is anaeroob.
Er wordt twee keer geent op de helling en in de voet (geprikt)
In het medium is in ieder geval glucose aanwezig in een relatief lage concentratie. Daarnaast zijn één (Kligleragar:lactose) of meer (TSI-agar :lactose en saccharose) andere suikers in een 10 keer zo hoge concentratie als glucose aanwezig. Wordt glucose voor de dissimilatie gebruikt dan ontstaan er zoveel zuren dat de toegevoegde pH-indicator naar geel omslaat, aanvankelijk zowel boven als onderin de buis. In het aërobe gedeelte vindt echter al snel neutralisatie plaats door aërobe omzettingen van aminozuren waarbij basische eindproducten ontstaan, de kleuromslag wordt weer ongedaan gemaakt en de er treedt zelfs een kleuromslag naar de basische kant (rood) op.
Maar wordt naast glucose een andere suiker omgezet dan ontstaat zoveel zuur (waarom nu wel?) dat dat aëroob niet meer kan worden geneutraliseerd door de aërobe basische reacties. Er zal na incubatie een totale verkleuring naar de zure kant van de pH-indicator plaatsvinden.De zwarte kleur wordt door H2S vorming veroorzaakt.
Voorbeelden:
 |
|
In beide buizen worden zowel glucose als lactose vergist. In de linkerbuis zie je ook gasvorming. |
In deze buizen is bovenin geen verkleuring naar geel= verzuring = vergisting te zien. Dus geen lactosevergisting. Onderin zie je rechts ook de verzuring onderin door glucosevergisting. Links is de glucosevergisting niet zichtbaar door de H2S vorming, maar omdat dit alleen kan plaatsvinden in een zuur milieu is ook hier sprake van glucosevergisting. |
Dit is een reactie waarbij men kan nagaan of een micro-organisme een gemengd zure gisting heeft, hierbij worden veel zuren gevormd. Door een pH-indicator met een relatief laag omslagpunt te kiezen zal alleen bij de gemengd zure gisting een kleuromslag bereikt worden. Op deze manier kan een onderscheid gemaakt worden tussen enerzijds Escherichia coli en anderzijds Enterobacter aerogenes. De reactie maakt deel uit van de IMViC-test.
Een ander eindproduct van een speciaal type gisting is de butaandiolgisting. Deze stof kan na incubatie van het micro-organisme in glucosebouillon worden aangetoond m.b.v. een kleurreactie. Butaandiol wordt door o.a. Enterobacter aerogenes gevormd maar niet door Escherichia coli een ander coliform micro-organisme zodat onderscheid mogelijk is. Zie ook IMViC test.
Ook Bacillussoorten kunnen met deze reactie van elkaar worden onderscheiden.